Klinische Prüfungen – Datenquelle
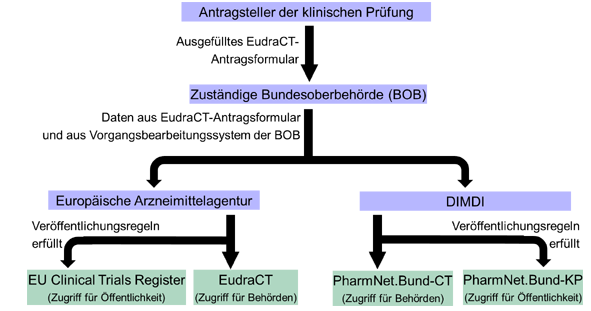
Vor einer klinischen Prüfung reicht der Antragsteller die notwendigen Angaben bei der zuständigen Bundesoberbehörde ein (BfArM oder PEI). Dazu dient das EudraCT-Antragsformular. Die Bundesoberbehörde leitet die überprüften Daten an das DIMDI weiter. Das DIMDI speichert alle eingehenden Daten in der Datenbank PharmNet.Bund - Clinical Trials (CT). Zugriff darauf besitzen die zuständigen Bundesoberbehörden und die Landesbehörden, die die klinischen Prüfungen überwachen. mehr »
Wenn die Voraussetzungen für die Veröffentlichung erfüllt sind, werden sie in die öffentliche Datenbank "Klinische Prüfungen" übernommen (siehe Veröffentlichungsregeln).
Die Daten aus dem EudraCT-Antragsformular werden auch an die Europäische Arzneimittelagentur (EMA) weitergeleitet. Diese speichert sie zusammen mit den Daten aus den anderen europäischen Mitgliedsstaaten in der Datenbank EudraCT, auf die nur die nationalen Behörden zugreifen können.
Auch bei der EMA wird überprüft, ob die Voraussetzungen für die Veröffentlichung erfüllt sind. Nur dann gelangen die Daten ins "EU Clinical Trials Register" (EU CTR).